Orbitale in Ethen und Benzol
(Clayden, Greeves & Warren, 2013; Latscha, Kazmaier & Klein, 2016; Schatz & Ratner, 2002)
Struktur von Ethen als Beispiel
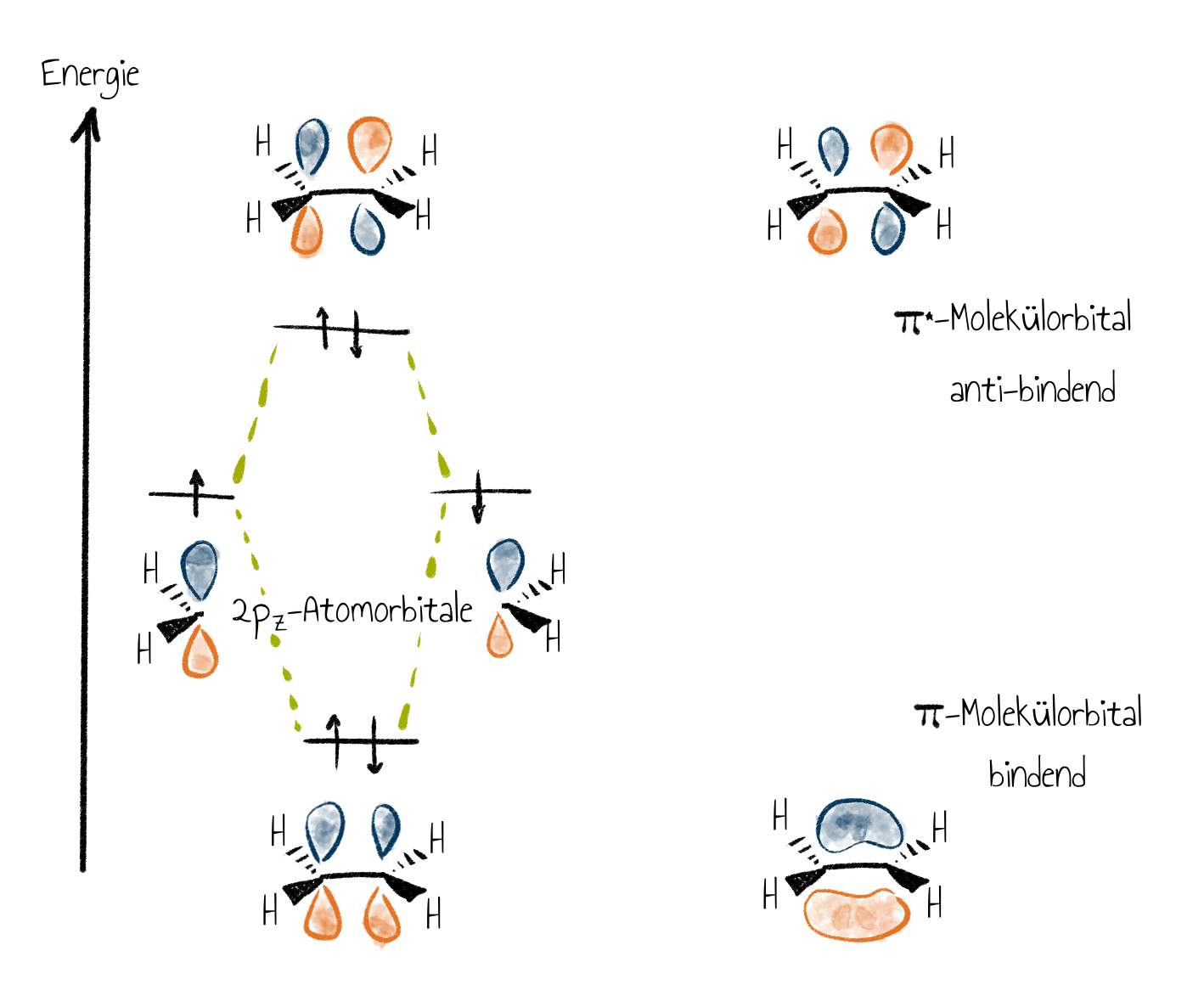
Das einfachste Molekül, das eine Doppelbindung enthält, ist Ethen. Es handelt sich dabei um ein planares Molekül – alle Atome liegen in einer Ebene –, bei dem die beiden $\mathrm{sp^2}$-hybridisierten Kohlenstoffatome trigonal von jeweils zwei Wasserstoffatomen umgeben sind. Zwischen den beiden Kohlenstoffatomen liegt eine Doppelbindung vor: Eine $\sigma$-Bindung als Überlappung von zwei $\mathrm{sp^2}$-Orbitalen und eine $\pi$-Bindung durch Überlappung zweier $\mathrm{p}$-Orbitale.
Anleitung: Auf die Bindungstypen ($\sigma$ oder $\pi$), um das zugehörige Molekülorbital in der 3D-Ansicht ein- bzw. auszublenden. Die Orbitale sind hier nur noch nach ihrer Intensität eingefärbt, nicht mehr nach dem Vorzeichen der Wellenfunktion. Dafür hat jedes Orbital eine andere Farbe, um sie besser zu unterscheiden.
Das $\pi$-System macht Ethen im Vergleich zu Ethan so interessant, weil die $\pi$-Elektronen es zum Nukleophil machen. Da zwei $\mathrm{p}$-Orbitale vorliegen, können sie entweder additiv oder subtraktiv kombiniert werden. Die additive Kombination führt zu einem bindenden $\pi$-Molekülorbital und die subtraktive Kombination zu einem antibindenden $\pi$-Molekülorbital.
Moleküle mit mehreren Doppelbindungen
Ein sehr bekanntes Beispiel, welches sich häufig als Grundbaustein in Farbstoffen findet, ist Benzol mit der Summenformel $\mathrm{C_6 H_6}$. Wie in Alkenen ist jedes Kohlenstoffatom $\mathrm{sp^2}$ hybridisiert, sodass sie zusammen mit den Wasserstoffatomen in einer Ebene liegen. Übrig bleiben die $\mathrm{p_z}$-Orbitale der $C=C$-Doppelbindungen, welche senkrecht zur Molekülebene stehen.
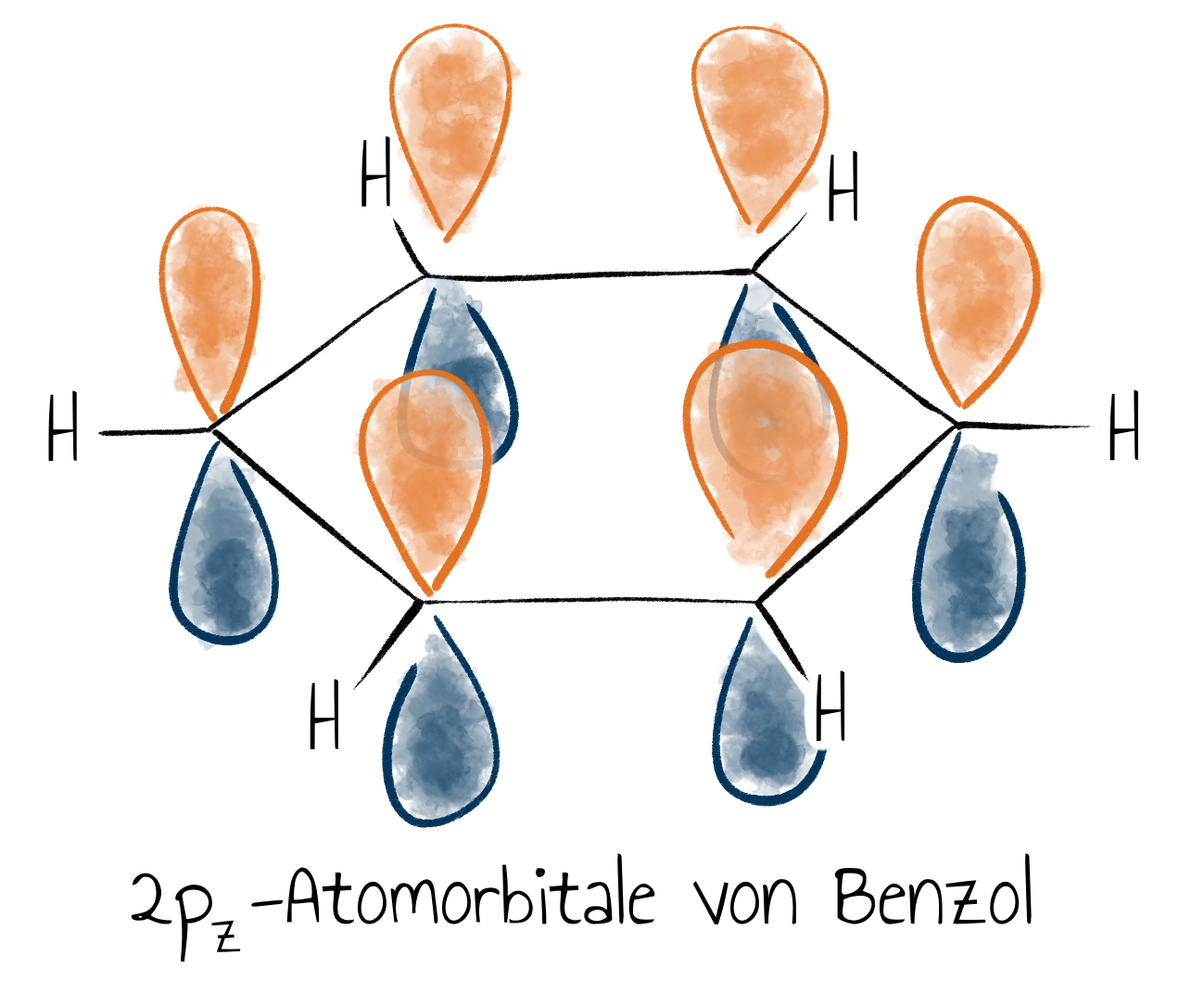
Die $\sigma$-Bindungen können klar zugeordnet werden, bei den $\pi$-Bindungen ist es schon etwas schwieriger, da zwei Kombinationsmöglichkeiten bestehen. Tatsächlich sind diese beiden Formen identisch, denn die sechs $\mathrm{p}$-Orbitale können zu sechs neuen Molekülorbitalen kombiniert werden, man bezeichnet sie als mesomere Grenzstrukturen oder spricht von dem Phänomen der Mesomerie.
Die beteiligten Elektronen befinden sich dann in einem Orbital, welches ringförmig ober- und unterhalb der Molekülebene liegt. Das bedeutet, dass die Elektronen gleichmäßig über die Kohlenstoffatome verteilt sind. Man spricht auch von einem delokalisierten $\pi$-Elektronensystem. Wie bei Ethen steigt die Energie der Elektronen in diesen $\pi$-Bindungen, wenn die Einzelorbitale anders orientiert sind.
Beides wird in der nachfolgenden Visualisierung veranschaulicht.
Anleitung: Mit dem Schieberegler das Energieniveau des delokalisierten $\pi$-Elektronensystems verändern und beobachten, wie die Orientierungen der $\mathrm{2p}$-Orbitale und der $\pi$-Bindungen sich entsprechend ändern.