Wann sind Stoffe farbig?
(Clayden, Greeves & Warren, 2013)
Bereits aus den vorherigen Abschnitten ist bekannt, dass Elektronen von einem Atomorbital in ein anderes gehoben werden können, wenn der passende Energiebetrag, z. B. in Form von Licht, auf sie wirkt. Genau das Gleiche ist mit Molekülorbitalen möglich. Dabei sorgt Licht der passenden Wellenlänge meist für einen Elektronenübergang vom höchsten besetzten Molkekülorbital (kurz HOMO von “highest occupied molecular orbital”) in das unterste nicht besetzte Molekülorbital (kurz LUMO von “lowest unoccupied molecular orbital”). Dies soll am Beispiel von Ethen und Butadien illustriert werden:
Die Energiedifferenz zwischen HOMO und LUMO bei Ethen ist größer als die von Butadien.
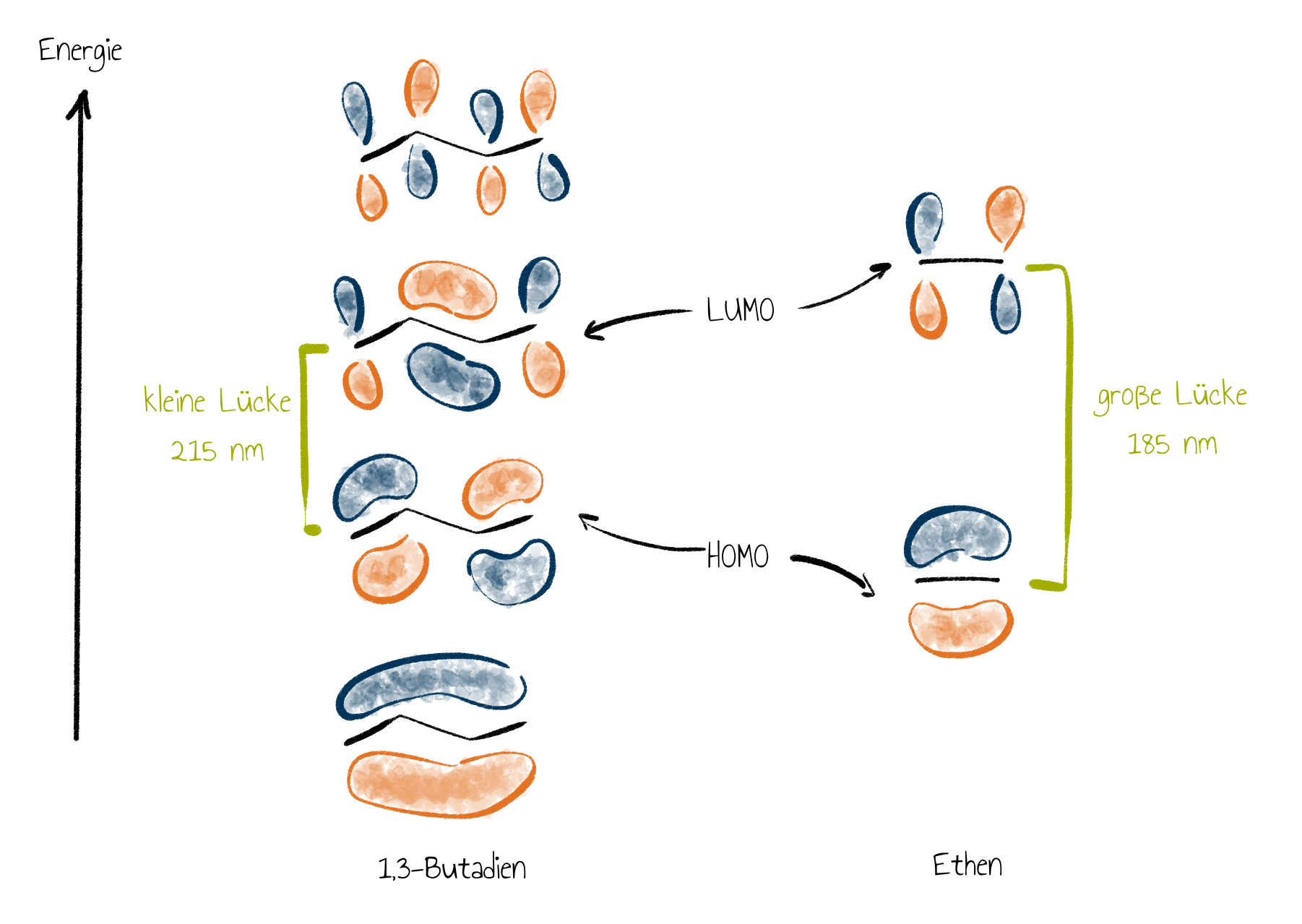
Das hat zur Folge, dass Butadien Licht mit einer größeren Wellenlänge absorbiert; denn je größer die Wellenlänge, desto geringer ist die Energie der Photonen. Dieser Zusammengang wird von den Schülerinnen und Schülern im Unterrichtsvideo in Gruppen erarbeitet und in Szene 6: Präsentation der Ergebnisse vorgestellt:
Für die Beispiele oben bedeutet dies, dass Butadien bei 215 nm und Ethen nur bei 185 nm absorbiert. Die Lücke zwischen HOMO und LUMO wird durch Konjugation verkleinert. Das heißt, je größer das delokalisierte $\pi$-Elektronensystem ist, desto größer ist die Wellenlänge des vom Stoff absorbierten Lichtes.
Anleitung: An den Schiebereglern diverse Parameter und Größen des Polyens ändern und beobachten, welche Farbe nicht absorbiert wird.
Weder Ethen noch Butadien absorbieren im sichtbaren Bereich des elektromagnetischen Spektrums, aber durch eine weitere Ausdehnung der Konjugation kann die Lücke zwischen HOMO und LUMO so klein werden, dass das Molekül sichtbares Licht absorbiert und es damit farbig erscheint. Dabei ist zu beachten, dass wir nicht die Farbe des absorbierten Lichtes wahrnehmen, sondern ihre Komplementärfarbe. Genaueres wurde im Abschnitt Farbenlehre behandelt. Dazu ein kleines Beispiel:
Tomaten enthalten den Farbstoff Lycopin, welches elf konjugierte Doppelbindungen besitzt (sowie zusätzlich zwei nicht konjugierte Doppelbindungen). Ein Blick in das elektromagnetische Spektrum von Lycopin zeigt, dass es hauptsächlich Licht im Bereich der Wellenlänge von 470 nm absorbiert. Dies entspricht blaugrünem Licht. Daher beobachten wir das reflektierte rotorange Licht und Tomaten erscheinen uns rot. Die folgende Tabelle liefert eine Übersicht zur Anzahl an Doppelbindungen und den daraus resultierenden sichtbaren Farben.