Indikatorfarbstoffe
(Mortimer & Müller, 2019)
Manche Farbstoffe ändern ihre Farbe, wenn eine Veränderung des pH-Wertes erfolgt. Solche Farbstoffe werden Säure-Base-Indikatoren genannt. Soll etwa der pH-Wert einer Lösung bestimmt werden, so ist dies durch Zugabe eines Säure-Base-Indikators schneller möglich als durch eine elektrochemische Messung. Jedoch ist diese Methode etwas ungenauer. Allgemein sind Säure-Base-Indikatoren schwache Säuren. Wegen ihrer intensiven Farbe genügt es, nur wenige Tropfen in die Probelösung zu geben, sodass ihr pH-Wert unverändert bleibt. Das undissoziierte Indikator-Molekül $\mathrm{H\,Ind}$ hat eine andere Farbe als seine konjugierte Base $\mathrm{Ind^-}$. Für Säure-Base-Indikatoren gilt folgendes Gleichgewicht:
\[\mathrm{H\,Ind} \quad\rightleftharpoons\quad \mathrm{H^+} + \mathrm{Ind^-}\]
Das bedeutet, wenn sich die Konzentration an $\mathrm{H}^+$-Ionen erhöht, also ein saures Milieu herrscht, verschiebt sich nach dem Prinzip von Le Chatelier das Gleichgewicht auf die linke Seite. Umgekehrt liegt das Gleichgewicht im Basischen auf der rechten Seite.
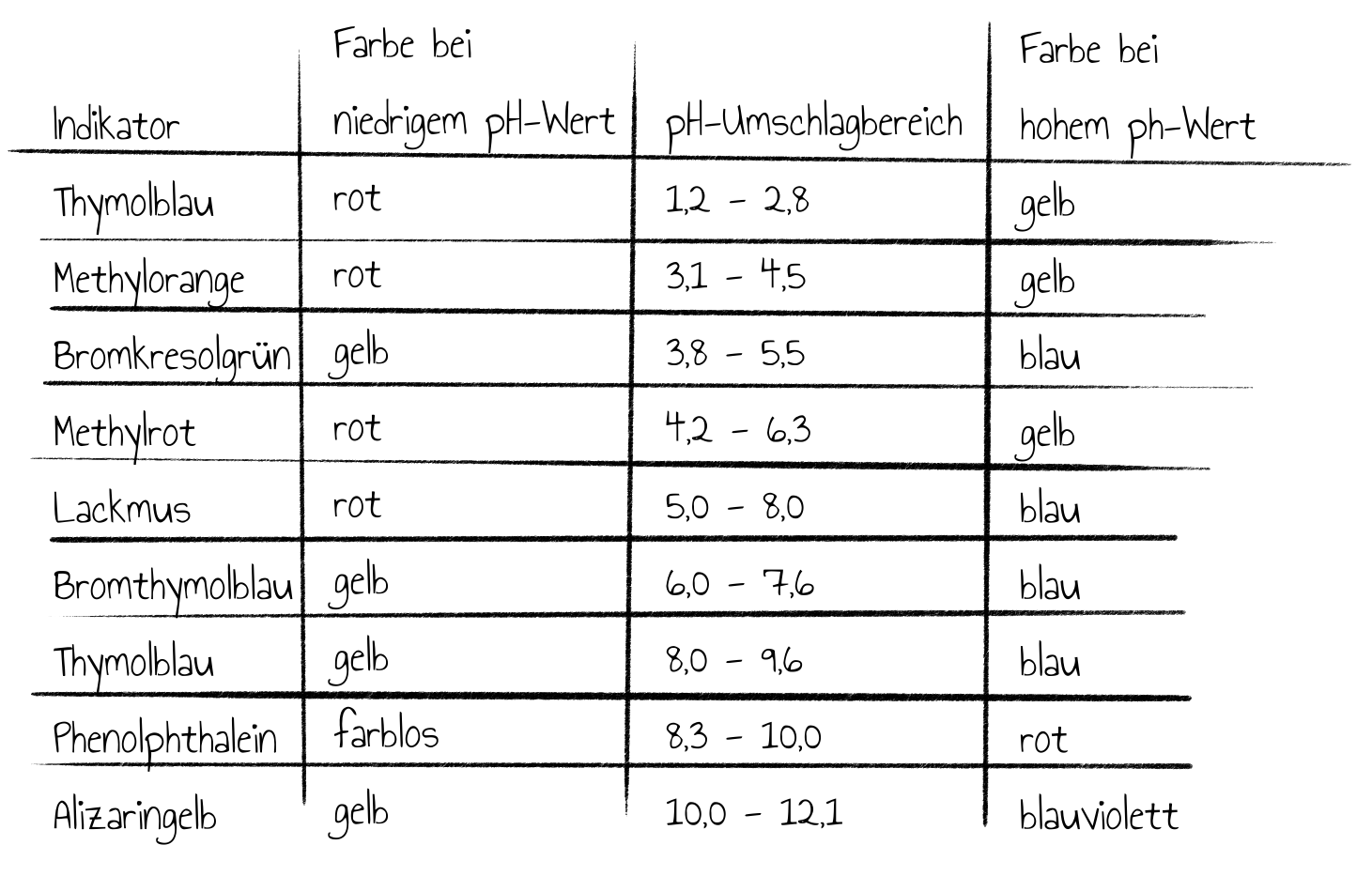
Der wohl bekannteste Säure-Base-Indikator ist Lackmus. Dies ist dabei ein Gemisch aus über einem Dutzend einzelner Farbstoffe, deren komplexes Zusammenspiel für die Farbänderungen bei pH-Wertunterschieden verantwortlich ist. Der Chromophor des Hauptbestandteils von Lackmus ist dabei 7-Hydroxyphenoxazone.
Anleitung: Mit dem Schieberegler zwischen 2D- und 3D-Ansicht hin- und herwechseln. Mit dem “2D eingeklappt”-Knopf die Substituenten in der 2D-Ansicht ein- und ausblenden. Mit dem “impliziter Wasserstoff”-Knopf die an den Kohlenstoffatomen implizit gegeben Wasserstoffatome ein- und ausblenden. Mit dem “3D Skelett”-Knopf die Kugel, die die Atome in der 3D-Ansicht darstellen, ein- und ausblenden.
Lackmus hat einen Umschlagbereich von $5,\negthinspace 0$ bis etwa $8,\negthinspace 0$. Das bedeutet: Ist der pH-Wert der Probelösung kleiner (also sauer), so verfärbt sie sich durch Zugabe weniger Lackmustropfen rot. Eine Probelösung mit einem größeren pH-Wert (also basisch) würde blau erscheinen. Der Grund dafür wurde in den vorherigen Kapiteln besprochen: Es erfolgt eine Vergrößerung des delokalisierten $\pi$-Elektronensystems beim Wechsel von der protonierten in die deprotonierte Form. Zum einen ergeben sich mehr mesomere Grenzstrukturen durch die Deprotonierung der Hydroxygruppen und die deprotonierte Form des Orceinrestes weist ebenfalls ein ausgedehnteres konjugiertes Doppelbindungssystem auf.
Lackmus ist ein Beispiel für einen natürlichen Farbstoff, der als Indikator genutzt werden kann. Zudem gibt es synthetische Indikatoren wie z.B. der Azofarbstoff Methylorange. Der Umschlagbereich liegt zwischen $3,\negthinspace 1$ und $4,\negthinspace 5$. In neutralem Milieu färbt sich der Indikator orange und in einer sauren Lösung färbt sich Methylorange rot, bei deutlich höheren pH-Werten erscheint er sogar gelb. Die verschiedenen Färbungen lassen sich wieder mithilfe der Molekülstruktur und einer genaueren Betrachtung des delokalisierten $\pi$-Elektronensystems erklären.
Es ist zu erkennen, dass die protonierte Form im sauren Milieu eine stärkere Elektronendelokalisierung vorweist als die deprotonierte Form.
Es gibt noch eine Vielzahl an weiteren Säure-Base-Indikatoren und alle beruhen auf dem Prinzip einer Vergrößerung oder Verkleinerung des delokalisierten $\pi$-Elektronensystem durch (De-)Protonierung. Die folgende Tabelle gibt abschließend eine kurze Übersicht zu den unterschiedlichen Indikatoren.